1. التفكك المباشر وامتزاز جزيئات الماء
في مواقع المعادن غير المشبعة من أكاسيد المعادن أو أكاسيد أشباه الموصلات (مثل Ti4+، Fe3+)، تمتز جزيئات الماء أولاً في شكل جزيئي، يليها انقسام رابطة OH، مما يؤدي إلى مجموعات الهيدروكسيل الطرفية أو الجسرية (M-OH) وذرات الهيدروجين السطحية. تأتي القوة الدافعة الديناميكية الحرارية لهذه العملية من حموضة لويس القوية لأيونات المعادن، مما يجعل جزيئات الماء سهلة الانفصال. تشير كل من التجارب وحسابات DFT إلى أن الأسطح المغطاة بكمية منخفضة من الأكسجين تميل إلى التفكك والامتصاص، بينما تميل الأسطح المغطاة بكمية عالية من الأكسجين إلى امتصاص الجزيئات.
2. شغور الأكسجين (VO) بوساطة توليد الهيدروكسيل
توفر الشواغر الأكسجين السطحي الإلكترونات، مما يجعل جزيئات الماء الممتزة أكثر عرضة للتفكك. بعد أن تمتز جزيئات الماء في الفراغ، تتولد مجموعتان من الهيدروكسيل، إحداهما تملأ الفراغ والأخرى معلقة على المعدن المجاور. تشرح هذه الآلية ظاهرة الزيادة الكبيرة في كثافة الهيدروكسيل تحت ظروف التخفيض أو درجات الحرارة المرتفعة، وترتبط ارتباطًا وثيقًا بالتغيرات في رقم التنسيق لأيونات المعادن.
3. تجاوز ذرة الهيدروجين أو الهيدروجين
عند السطح البيني للمعدن/الأكسيد، يتفكك الهيدروجين على المعدن ليشكل H⁺/H⁻، والذي يهاجر بعد ذلك إلى سطح أكسيد الفلز من خلال فيضان الهيدروجين ويشكل مجموعات هيدروكسيل مع الأكسجين السطحي. وقد لوحظت هذه العملية مباشرة في الأنظمة الحفزية مثل أكسدة ثاني أكسيد الكربون في درجات الحرارة المنخفضة، كما أدى تدفق الهيدروجين إلى زيادة كبيرة في معدل توليد مجموعة الهيدروكسيل السطحية.
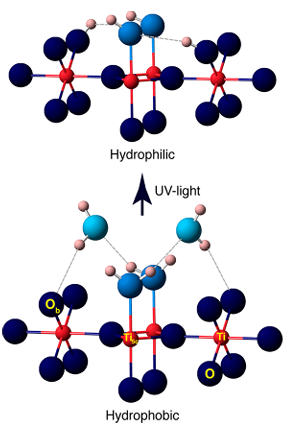
4. التحفيز الضوئي/الأشعة فوق البنفسجية المستحثة بتكوين الهيدروكسيل
يعمل ضوء الأشعة فوق البنفسجية على إثارة أشباه الموصلات مثل TiO2 لتوليد أزواج ثقب الإلكترون، التي تلتقط ذرات الأكسجين السطحية لتكوين O ⁻، ثم تتفاعل مع جزيئات الماء الممتزة أو مجموعات الهيدروكسيل لتوليد OH ⁻ السطحي، مصحوبًا بإنتاج جذور الهيدروكسيل (· OH). أظهرت التجارب أن الأشعة فوق البنفسجية تولد شواغر أكسجين إضافية على سطح TiO2، والتي تتفاعل أيضًا مع الماء لتوليد المزيد من مجموعات الهيدروكسيل، مما يؤدي إلى محبة فائقة للماء مستحثة بالصور.
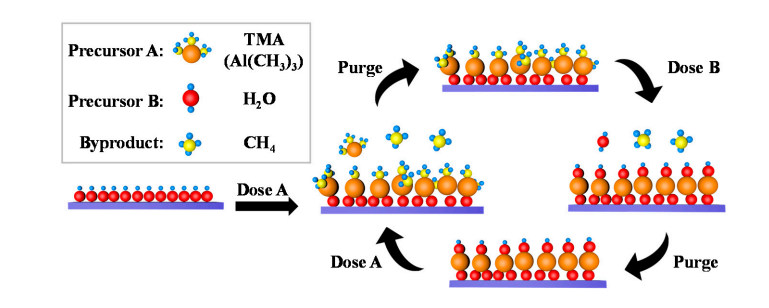
5. تكوين مجموعات الهيدروكسيل على سطح أكسيد الألومنيوم
توجد كمية صغيرة من مجموعات الهيدروكسيل بشكل طبيعي على سطح أكسيد الألومنيوم، وتتفكك جزيئات الماء وتمتز على مجموعات الهيدروكسيل هذه، مما يؤدي إلى إنتاج Al-OH جديد. أثناء ترسيب الطبقة الذرية (ALD)، يخضع TMA (ثلاثي ميثيل الألومنيوم) لتبادل التنسيق مع مجموعات الهيدروكسيل السطحية لتشكيل روابط Al-O-Al وإطلاق الميثان؛ بعد ذلك، يتفاعل نبض الماء مرة أخرى مع روابط Al-O لتجديد مجموعات الهيدروكسيل السطحية، مما يحقق تجديدًا دوريًا لمجموعات الهيدروكسيل.
6. إعادة بناء السطح - تؤدي هجرة المعادن إلى تراكم الهيدروكسيل
على السطح البلوري للألومينا أو أكسيد التيتانيوم، تهاجر أيونات المعادن المحلية (مثل Al3+) إلى الشواغر السطحية تحت درجة حرارة عالية أو إمكانات هيدروكيميائية عالية، لتشكل مجموعات هيدروكسيل من النوع Al (OH) 3 أو Ti (OH) 3. يصاحب عملية إعادة البناء هذه تشويه شبكي، مما يجعل امتصاص مجموعات الهيدروكسيل على جزيئات الماء المجاورة أكثر ملاءمة، مما يشكل طبقة قاعدة هيدروكسيل عالية الكثافة.
7. آلية التحلل المائي لمجموعات الهيدروكسيل على سطح السيليكون
عند رابطة الجسر Si-O-Si، تتحد جزيئات الماء مع رابطة أكسجين السيليكون من خلال نقل إلكترون البروتون التآزري، لتشكل مجموعات Si-OH. هذه العملية مهمة بشكل خاص في التآكل الناتج عن الإجهاد عند طرف الكراك والتحلل المائي السطحي للزجاج، وقد تمت ملاحظة تعزيز اهتزاز الشد Si-OH مباشرة بواسطة التحليل الطيفي التجريبي للأشعة تحت الحمراء.
SAT NANO هو أفضل مورد لمسحوق النانو والجسيمات الدقيقة في الصين، يمكننا تقديم مسحوق أنابيب الكربون النانوية، مثل
موكنت-COOH,
موكنت-أوه، إذا كان لديك أي استفسار، فلا تتردد في الاتصال بنا على sales03@satnano.com